米国UDI規制のためのGS1バーコード利用
現在、米国では、医療機器等(医療機器および体外診断用医薬品)にバーコードを表示するUDI(Unique Device Identification)規制が施行されています。GS1標準の商品識別コード(GTIN)とバーコードは米国FDAによって認められた標準ですが、GS1は、米国市場で販売される医療機器等に対して、どの事業者が、どのGS1事業者コードを使用しているかを、毎年米国FDAに報告することを義務づけられています。
そのため、医療機器等にGTINを設定して米国で販売する場合、およびその予定がある場合は、以下の内容をご確認いただき、必ず当財団に事前に当該医療機器等のGTIN設定に使用するGS1事業者コードの使用宣言を行ってください。
詳細は以下をご覧ください
UDI規則とは?
UDI(Unique Device Identification)とは、医療機器を固有に識別する事あるいはその識別情報を指します。2010年代以降、医療機器等の識別管理やトレーサビリティの確保等による医療安全性の向上を目指し、欧米をはじめUDI規則の公表・実施をする国が増えてきています。
UDIの実現においては下記のようなシステムが前提とされており、このためほとんどの国のUDI規則では、医療機器等への製造識別情報も含めたバーコード表示、および機器識別情報のデータベース登録が定められています。また、国際標準であるGS1は、ほとんどの国の規則においてUDI発番機関と認定されています。
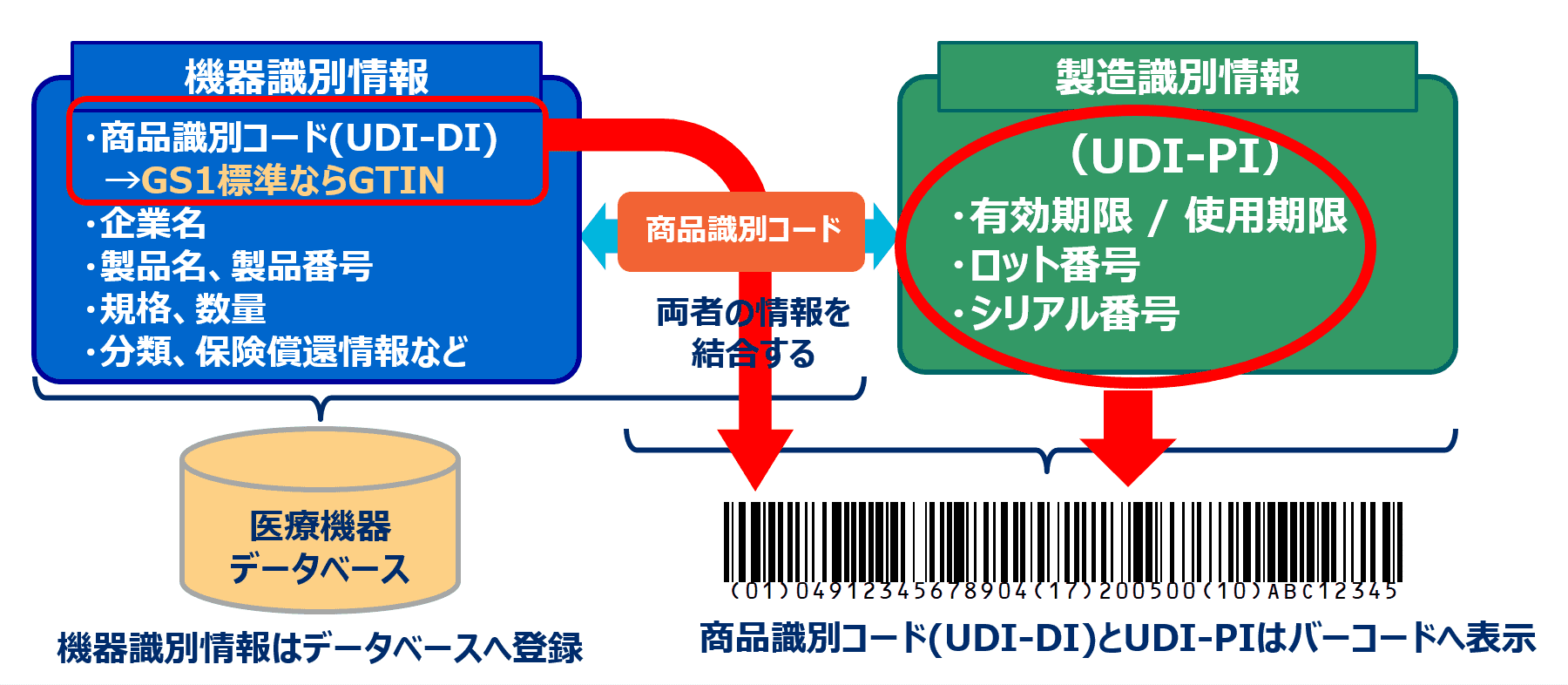
米国FDAによるUDI規則とGS1の関係
米国では、2013年にFDA(米国食品医薬品局)よりUDI規則が公表され、 2014年 9 月以降、上記のように医療機器等へのバーコード表示と医療機器データベース(GUDID)への製品情報登録が段階的に義務化されてきています。 GS1は、FDAにより認可されたUDI発番機関です。そのため、米国市場で医療機器等を販売する企業は、GS1標準の商品識別コード(GTIN)とバーコードを利用し、製品への表示やGUDIDへの登録を行うことで、本規制への対応が可能となっております。
一方でGS1 は、米国市場で販売する医療機器等を識別するためにGTINやGS1標準のバーコードを使用している事業者および対象のGS1事業者コードを、FDA に申告しています。これは、FDAのUDI規則内で、発番機関であり続けるための義務として定められていることです。
事業者側で対応が必要なこと
①医療機器等にGTINを設定して米国で販売する場合(予定を含む)のGS1事業者コードの使用宣言
上記のため、医療機器等にGTINを設定して米国で販売する場合は、必ず事前にその商品へのGTIN設定に使用するGS1事業者コードの使用宣言を行ってください。すでに使用が確定している場合だけでなく、今後使用が見込まれる場合も、予定が判明した時点での使用宣言が必要です。事前の使用宣言が行われていない場合、貴事業者の商品に関わる米国内での諸手続き等に障害が起こる可能性がありますのでご注意ください。
宣言方法
【新規・更新申請時の場合】
インターネットでの申請情報入力時に「UDI(医療機器固有識別)利用有無」という項目がありますので、「はい」を選択してください。
※申請後、担当より詳細確認をさせていただく場合がございます。
【上記以外の場合】
こちらよりお問い合わせください。
②当財団から依頼があった場合のUDIデータベース登録内容の是正
GUDID登録情報との突合により、GS1事業者コードやGTINの不適切な使用の可能性が判明した場合、当財団から該当の事業者様へ詳細を確認させていただき、データの是正依頼等をさせていただく場合があります。この場合は所定の期間内にご対応をお願いいたします。当財団からの通知を受け、所定の期間を経過してもデータが是正されない場合、貸与規約第15条1項によりGS1事業者コードが取り消される可能性がありますのでご注意ください。
お問い合わせ先
質問内容により、該当するリンク先よりお問い合わせをお願いいたします。